O que é infecção urinária?
Ela é caracterizada pela a presença de micro-organismos na urina. O líquido que enche a bexiga é estéril - ou seja, livre de bactérias. Mas, quando esses bichinhos se multiplicam ao redor da uretra e conseguem se infiltrar no canal da urina até chegar à bexiga, desencadeiam uma infecção. "Em 85 % dos casos, o problema é provocado pela bactéria Escherichia coli, que integra a flora intestinal", ressalta Fernando Almeida, professor de urologia da Universidade Federal de São Paulo.
Existem tipos diferentes? Sim. O mais comum é a infecção na bexiga, a famosa cistite. Mas os micro-organismos também podem atacar os rins, o que é chamado de pielonefrite.
Quais são os sintomas?
"Os clássicos são dor e ardor na hora de urinar", afirma Eduardo Zlotnik, ginecologista e obstetra do Hospital Israelita Albert Einstein, em São Paulo. Pode haver também um aumento da frequência de idas ao banheiro, sensação de bexiga cheia, sangramento ou um simples mal-estar acompanhado de febre.
A doença é transmissível?
"Definitivamente, não", assegura Fernando Almeida. Mas é mais comum que ela dê as caras depois de relações sexuais, porque o pH da região fica alterado. Entre mulheres que variam muito de parceiro, a incidência é comprovadamente maior.
Por que esse tipo de infecção é mais frequente em mulheres?
Elas têm o canal da uretra mais curto e, por isso, é mais fácil as bactérias chegarem aonde não devem. Além disso, elas costumam ter o péssimo hábito de segurar a urina por mais tempo que os homens - um prato cheio para as bactérias se proliferarem.
Por que algumas pessoas têm o problema com mais frequência? Isso envolve fatores hereditários e imunológicos. A atenção com a higiene é essencial, mas a infecção pode aparecer mesmo em quem toma todo o cuidado do mundo.
Por que as grávidas ficam mais sujeitas a esse tipo de infecção? Estima-se que de 15% a 20% das gestantes terão ao menos uma vez esse tipo de infecção. Isso acontece porque, durante esse período, o aumento da circulação sanguínea na região pélvica faz a umidade vaginal aumentar, facilitando a passagem das bactérias do ânus para a uretra.
Os homens estão livres da doença? Não é bem assim. É verdade que esse é um problema tipicamente feminino, mas a infecção também acomete a ala masculina.
Ela é mais frequente em pessoas idosas? Sim. "A resistência diminui com a idade e, no caso das mulheres, há uma queda de hormônios que deixam a região pélvica mais sensível", diz Eduardo Zlotnik.
Existe alguma forma de prevenir? Segundo Zlotnik, a recomendação é beber muita água para que as idas ao banheiro não fiquem muito espaçadas. "Assim você vai limpando o trato urinário", explica. Urinar depois das relações sexuais e evitar banhos de imersão também ajudam.
Fonte: Saúde.abril.com.br
quarta-feira, 21 de novembro de 2012
terça-feira, 20 de novembro de 2012
10 Passos para controlar a pressão arterial
.
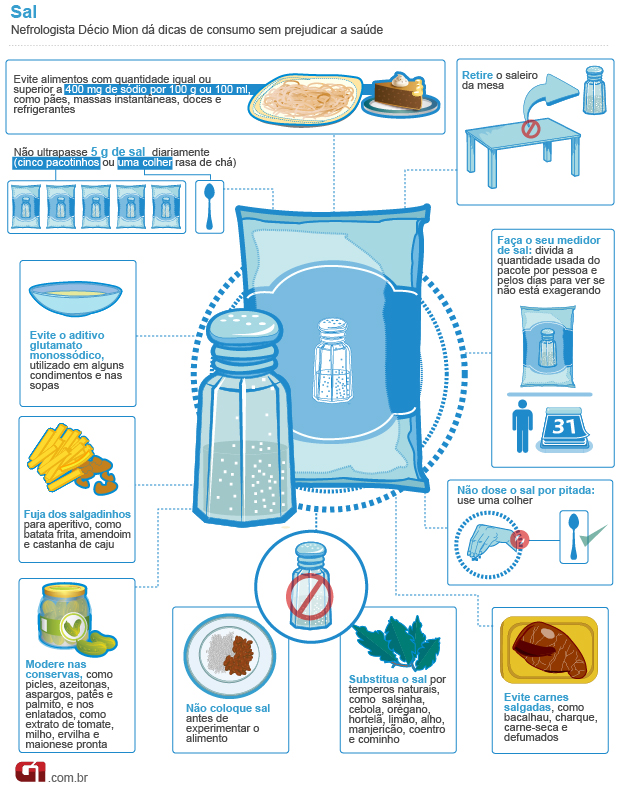
1.Manutenção do peso ideal- o sobrepeso aumenta dificulta o esforço do coração para conseguir bombear o sangue. Na prática, o músculo é exigido demais. "Como o bíceps de quem levanta peso, o coração de uma pessoa obesa acaba hipertrofiado" , explica o cardiologista. Com um risco: as lesões causadas pelo esforço excessivo podem se tornar irrecuperáveis.
2. Prática de atividade física atividades físicas regulares, principalmente as aeróbias, contribuem para a melhora de todo o sistema circulatório e pulmonar. Só tome cuidado com os exageros: antes de começar qualquer treino, procure um especialista e faça uma avaliação geral.
3. Redução de sal - o excesso de sal na dieta leva à retenção de líquidos, acarretando a hipertensão. Por isso, maneire na hora de temperar a comida e diminua o consumo de enlatados e alimentos em conserva.
2. Prática de atividade física atividades físicas regulares, principalmente as aeróbias, contribuem para a melhora de todo o sistema circulatório e pulmonar. Só tome cuidado com os exageros: antes de começar qualquer treino, procure um especialista e faça uma avaliação geral.
3. Redução de sal - o excesso de sal na dieta leva à retenção de líquidos, acarretando a hipertensão. Por isso, maneire na hora de temperar a comida e diminua o consumo de enlatados e alimentos em conserva.
 cigarro
cigarro
4. Evitar bebidas alcoólicas: O álcool em grande quantidade é inimigo feroz da pressão sob controle. Corte as bebidas da sua dieta ou consuma com muita moderação.
5. Dieta saudável: Gorduras saudáveis e pouco sal são medidas indispensáveis na dieta de quem quer manter o coração saudável. Inclua ainda muitas frutas, verduras e legumes. Cortar a carne não é preciso, mas dê preferência aos cortes magros, ou seja, com menos gordura.
6. Medicamentos: se o médico recomendou, não deixe de tomar. Mas nada de sair por aí imitando a receita alheia. Vale lembrar que alguns medicamentos podem elevar a pressão, como os antiiflamatórios e anticoncepcionais, ressalta o cardiologista.
7. Cigarro: o tabaco, em conjunto às outras substâncias tóxicas do cigarro, eleva a pressão imediatamente além de comprometer toda sua saúde. Parar de fumar imediatamente é fundamental , alerta o professor de Cardiologia da Santa Casa de São Paulo, Ronaldo Rosa.
5. Dieta saudável: Gorduras saudáveis e pouco sal são medidas indispensáveis na dieta de quem quer manter o coração saudável. Inclua ainda muitas frutas, verduras e legumes. Cortar a carne não é preciso, mas dê preferência aos cortes magros, ou seja, com menos gordura.
6. Medicamentos: se o médico recomendou, não deixe de tomar. Mas nada de sair por aí imitando a receita alheia. Vale lembrar que alguns medicamentos podem elevar a pressão, como os antiiflamatórios e anticoncepcionais, ressalta o cardiologista.
7. Cigarro: o tabaco, em conjunto às outras substâncias tóxicas do cigarro, eleva a pressão imediatamente além de comprometer toda sua saúde. Parar de fumar imediatamente é fundamental , alerta o professor de Cardiologia da Santa Casa de São Paulo, Ronaldo Rosa.
8. Estresse: ele aparece como resposta do organismo às sobrecargas físicas e emocionais, acarretando a hipertensão e doenças do coração. Controle suas emoções e procure incluir atividades relaxantes na sua rotina.
9. Exames médicos: avaliações regulares não só ajudam a identificar o problema no começo, facilitando o tratamento, como servem para adequar o uso de medicamentos de forma mais eficaz.
10. Medir a pressão: no mínimo uma vez por ano, todas as pessoas devem fazer isso. A recomendação é da Sociedade Brasileira de Hipertensão, que alerta para esse simples exame como uma forma de prevenir problemas mais sérios.
9. Exames médicos: avaliações regulares não só ajudam a identificar o problema no começo, facilitando o tratamento, como servem para adequar o uso de medicamentos de forma mais eficaz.
10. Medir a pressão: no mínimo uma vez por ano, todas as pessoas devem fazer isso. A recomendação é da Sociedade Brasileira de Hipertensão, que alerta para esse simples exame como uma forma de prevenir problemas mais sérios.
Fonte: Minhavida.com.br e G1.com
Conheça 8 formas de evitar o diabetes
O diabetes tipo 2 é uma doença que pode surgir a partir da combinação de dois fatores: o genético, ou seja, o histórico da doença na família, e o ambiental, que são fatores de risco para o problema, como obesidade e sedentarismo. Isso não quer dizer, porém, que uma pessoa sem histórico familiar não possa desenvolver a doença. No entanto, médicos ouvidos pelo site de VEJA concordam em uma coisa: hábitos saudáveis reduzem de forma significativa o risco do diabetes tipo 2.








A doença — Enquanto o diabetes tipo 1 ocorre pela falta da produção de insulina, hormônio que controla os níveis de glicose no sangue, no do tipo 2 a insulina continua a ser produzida normalmente, mas o organismo desenvolve resistência ao hormônio. Segundo o Ministério da Saúde, essa doença, nas duas modalidades, atinge 5,2% dos homens e 6% das mulheres. Entre as pessoas acima de 65 anos, a incidência é de 21%.
"O diabetes tipo 2 está muito relacionado à obesidade. A gordura que se acumula no abdome promove inflamação e obriga o pâncreas a produzir cada vez mais insulina para que a glicose entre nas células", diz Celso Cukier, médico nutrólogo do Hospital Albert Einstein. Como não há nada que possa ser feito quanto à predisposição genética para uma doença, Cukier explica que a manutenção do peso (ou o emagrecimento) e uma vida fisicamente ativa são essenciais para reduzir o risco do diabetes. Além disso, como atestaram várias pesquisas científicas, há outros hábitos e determinados alimentos que podem ajudar nessa proteção. Veja abaixo quais são eles.
Perca a barriga

Um dos principais fatores de risco para o diabetes tipo 2 é o acúmulo da gordura visceral, ou seja, a gordura acumulada na região abdominal que também se concentra no fígado e entre os intestinos. “Essa gordura obriga o pâncreas a produzir cada vez mais insulina para que a glicose consiga entrar nas células. Esse excesso estimula uma série de mudanças no metabolismo, como aumento da pressão arterial e das taxas de colesterol no sangue”, explica Carlos Alberto Machado, diretor da Sociedade Brasileira de Cardiologia. Portanto, o ganho de peso pode significar o aumento da gordura visceral e, consequentemente, do risco de diabetes tipo 2.
Faça 30 minutos de atividade física diária

Muitos estudos já relacionaram o exercício físico ao menor risco de diabetes tipo 2, assim como outras pesquisas mostraram que o sedentarismo pode levar ao desenvolvimento da doença. Em 2002, um estudo clássico sobre diabetes, o Diabetes Prevention Program (DPP), mostrou que uma mudança no estilo de vida é melhor para evitar a doença do que medicamentos como a metformina, que reduz a resistência à insulina. Essa mudança no estilo de vida significa 150 minutos de atividade física por semana, uma melhora na alimentação e a perda de 7% do peso corporal em seis meses. “Embora a pesquisa tenha sido feita há dez anos, seus resultados foram comprovados pelos estudos que vieram depois”, diz Carlos Alberto Machado, diretor da Sociedade Brasileira de Cardiologia (SBC).
Cuidado com o sono

Um estudo da Universidade Harvard, nos Estados Unidos, que foi publicado neste ano mostrou que dormir mal — ou seja, pouco ou de forma inconstante — aumenta o risco tanto de obesidade quanto de diabetes. Isso ocorre porque noites mal dormidas alteram o relógio biológico e retardam o ritmo metabólico. Essa redução pode significar um aumento de 4,5 quilos ao ano sem qualquer alteração da prática de atividade física ou dos hábitos alimentares. Com isso, há o risco do aumento de glicose e resistência à insulina no organismo, fatores que podem levar ao diabetes.
Controle o stress

Por diferentes motivos, o stress pode elevar o risco de uma pessoa desenvolver diabetes tipo 2. Umapesquisa feita no Canadá com mais de 7.000 mulheres, por exemplo, concluiu que o stress no trabalho chega a dobrar o risco de mulheres terem a doença. Os autores desse estudo mostraram que o problema emocional está ligado a um maior consumo de alimentos gordurosos e calóricos e a um maior sedentarismo, fatores que aumentam as chances de desenvolver a doença. Além disso, o trabalho sugeriu que o diabetes se favorece por perturbações geradas nos sistemas neuroendocrinológico e imunológicos, que provocam maior produção de hormônios como o cortisol e a adrenalina.
Coma pouco e devagar e não faça jejum

Comer muito, especialmente alimentos calóricos e gordurosos, aumenta o acúmulo da gordura abdominal, um fator de risco importante para o desenvolvimento do diabetes tipo 2. No entanto, não é só a qualidade e a quantidade do que se come que interfere nas chances da doença aparecer. De acordo com uma pesquisa apresentada no Congresso Internacional de Endocrinologia, em maio deste ano, na Itália, a incidência do diabetes é maior em pessoas que comem muito rápido em comparação com quem come mais devagar. O risco, segundo esse estudo, pode chegar a ser 2,5 vezes maior. A frequência com que comemos também interfere nessa probabilidade: uma pesquisa apresentada durante a FeSBE (Reunião Anual da Federação de Sociedades de Biologia Experimental) de 2011, mostrou que intercalar períodos de jejum e comilança pode causar diabetes, perda de massa muscular e aumentar a produção de radicais livres
Sempre que puder, evite comer gordura

A gordura abdominal favorece a resistência a insulina, quadro que está relacionado ao diabetes tipo 2. Portanto, alimentos gordurosos são fatores de risco para a doença, como provaram diversos estudos sobre o assunto. Pesquisadores da Harvard, por exemplo, concluíram que o risco de desenvolver diabetes tipo 2 aumenta 51% se forem consumidos 50 gramas de carne vermelha processada por dia, e 19% se forem ingeridos 100 gramas diárias de carne vermelha não processada. No entanto, algumas mudanças nos hábitos alimentares podem evitar a doença. No mesmo estudo, esses especialistas mostraram que se uma pessoa que consome 100 gramas de carne vermelha todos os dias substitui o alimento por frutas secas para obter a mesma quantidade de proteínas, o risco diminui em 17%. Este número aumenta para 23% se forem consumidos cereais integrais.
Prefira alimentos integrais

Os alimentos integrais, como pães e arroz, por exemplo, são excelentes alternativas para substituir alimentos que possuem farinha de trigo, como o pão francês. Esse tipo de comida é conhecida por elevar rapidamente as taxas de glicose no sangue, o que pode favorecer o surgimento do diabetes tipo 2, especialmente entre pessoas com maior risco da doença. Açúcar branco, frutas em calda enlatadas e batatas também possuem alta carga glicêmica. "Quanto menor o índice glicêmico, melhor para o paciente evitar a doença. Alimentos ricos em fibra e integrais são ideais para isso", diz o médico Celso Cukier.
Coma frutas, mas não exagere

Frutas fazem parte de uma alimentação saudável e devem ser ingeridas todos os dias. Porém, há uma grande disparidade na quantidade de frutose, o açúcar das frutas e do mel, que elas contêm. Como ela é metabolizada diretamente pelo fígado, não precisa de insulina para sua quebra primária. Porém, isso não permite o seu consumo em excesso. "A fruta tem muito carboidrato e frutose, mas ela não pode ser eliminada da dieta. Por isso, pessoas predispostas ao diabetes tipo 2 devem evitar as mais adocicadas, como as uvas ou o caqui, ou então consumí-las de forma moderada", diz Roberto Betti, coordenador do Centro de Diabetes do Hospital Alemão Oswaldo Cruz.
Fonte: Veja.com
Transplante de célula de focinho faz cão voltar a andar
 Cientistas da Universidade de Cambridge conseguiram reverter a paralisia em cachorros, após injetar células retiradas do focinho dos animais.
Cientistas da Universidade de Cambridge conseguiram reverter a paralisia em cachorros, após injetar células retiradas do focinho dos animais.
De acordo com os pesquisadores, as descobertas mostram, pela primeira vez, que transplantando este tipo de células em uma medula muito lesionada pode trazer melhoras significativas e abre novas possibilidades.
"Acreditamos que a técnica pode vir a ser usada para recuperar parte dos movimentos em pacientes humanos com lesões na medula vertebral, mas há um longo caminho a percorrer até podermos afirmar que eles serão capazes de recuperar todos os movimentos perdidos", diz o biólogo, Robin Franklin que participou da pesquisa.
O estudo foi financiado pelo Conselho Médico de Pesquisa (MRC, na sigla em inglês) da Grã-Bretanha e publicado no jornal científico "Brain".
A pesquisa é a primeira a testar transplantes em animais com lesões sofridas na vida real, ao invés de usar cobaias de laboratório.
Em uma parceria do Centro de Medicina Regenerativa do MRC e a Escola de Veterinária de Cambridge, os cientistas retiraram amostras de células olfativas do focinho dos cães e as cultivaram em laboratório durante várias semanas.
Os 34 cachorros que participaram da pesquisa haviam sofrido lesões na coluna que os impediam de usar as patas traseiras.
Em 23 dos cães, foram injetadas células olfativas na coluna; nos outros 11, o chamado grupo controle, foi usada uma solução aquosa neutra, sem nenhum efeito, para ser usado como termo de comparação.
Enquanto muitos dos cachorros que receberam o transplante de células apresentaram melhoras significativas e voltaram a andar, nenhum dos caninos do grupo de controle apresentou movimento nas patas traseiras.
Porque o nariz?
Após chegar a idade adulta, o nariz é a única parte do corpo em que terminações nervosas continuam a crescer.
Após chegar a idade adulta, o nariz é a única parte do corpo em que terminações nervosas continuam a crescer.
As células foram retiradas da parte posterior da fossa nasal. São células especiais que rodeiam os neurônios receptores que nos permitem sentir cheiros e convergir estes sinais para o cérebro.
Os cientistas dizem que as células transplantadas regeneraram fibras na região lesionada da medula. Isto possibilitou que cachorros voltassem a usar as suas patas traseiras e coordenar o movimento com as patas da frente.
Em humanos, o procedimento poderia ser usado em combinação com outras drogas para promover a regeneração da fibra nervosa e substituir tecidos lesionados.
Geoffrey Raisman, o especialista em regeneração neurológica da University College London, descobriu em 1985 este tipo de célula olfativa, que foi usada na pesquisa de agora.
Ele avalia que este foi o maior avanço dos últimos anos na área, mas diz que não é a cura para lesões de medula. "O procedimento permitiu que um cachorro lesionado voltasse a usar suas pernas traseiras, mas as diversas outras funções perdidas em uma lesão de medula, como uso da mão, controle da bexiga e regulação de temperatura, por exemplo, são mais complicados e ainda estão muito distantes".
Na pesquisa, as novas conexões não ocorreram em longas distâncias, necessárias para conectar o cérebro a medula. Os pesquisadores do MRC disseram que em humanos isto seria vital para pacientes com lesões na medula, que perderam funções sexuais e o controle da bexiga e do intestino.
Entre os cães com história de sucesso, está Jasper, um bassê, de dez anos de idade. "Antes do tratamento, nós usávamos um carrinho de rodas porque as suas patas traseiras eram inúteis, mas agora ele corre pela casa e no jardim e acompanha os outros cachorro, é maravilhoso", comemorou sua dona, May Hay.
Fonte: Globo.com
Exame de câncer de mama em 3D tem maior precisão, diz estudo
Uma técnica recente que usa imagens tridimensionais para rastrear o câncer de mama tem aumentado a precisão do diagnóstico e reduzido as taxas de resultados falsos positivos, segundo novo estudo publicado na revista científica "Radiology".
O exame, chamado tomossíntese, é o primeiro avanço importante na triagem das mamas desde o desenvolvimento da ressonância magnética para avaliar os seios, na opinião da principal pesquisadora, Elizabeth Rafferty, do Centro Avon para Compreensão do Câncer de Mama, do Hospital Geral de Massachusetts, em Boston, nos EUA.
Ao contrário de uma mamografia digital, que envolve duas radiografias de cada mama, a tomossíntese – aprovada pela agência americana Food and Drug Administration (FDA) em fevereiro de 2011 – capta várias imagens de diferentes ângulos ao redor dos seios. Esse material é, então, usado para fazer uma reconstrução tridimensional da região.
 Novo exame associado à mamografia aumenta a precisão do rastreio de câncer (Foto: Reprodução / TV Tem)
Novo exame associado à mamografia aumenta a precisão do rastreio de câncer (Foto: Reprodução / TV Tem)
A pesquisa envolveu 1.192 mulheres em cinco lugares diferentes, das quais 997 tinham dados completos. Cada uma das participantes foi submetida a uma mamografia digital padrão, seguida de uma tomossíntese – que pode ser feita no mesmo equipamento da mamografia e tem doses de radiação inferiores ao limite aprovado pela FDA.
Os autores então escolheram 622 casos e os dividiram em dois estudos: um com 312 mulheres e 48 casos de câncer, e outro com 310 mulheres e 51 registros de tumor. Doze radiologistas participaram do primeiro trabalho e 15 do segundo.
O uso conjunto da mamografia digital com a tomossíntese aumentou a precisão do diagnóstico para todos os médicos. No primeiro estudo, a precisão foi elevada em 10,7% e no segundo, em 16%. Já as taxas de falso positivo diminuíram 38,6% na primeira pesquisa e 17,1% na segunda – evitando, assim, a repetição desnecessária de exames.
A autora Elizabeth Rafferty destaca que os ganhos de sensibilidade ao usar técnicas combinadas podem ajudar principalmente na detecção de cânceres mais invasivos, com maior risco de metástase – quando a doença se espalha rapidamente para outros órgãos do corpo.
Segundo o Instituto Nacional do Câncer dos EUA, há evidências de que a mamografia seja capaz de reduzir a mortalidade por câncer de mama em mulheres entre 40 e 74 anos. Apesar disso, cerca de 30% desse tipo de tumor não é detectado no exame.
Outros 10% das pacientes recebem um diagnóstico falso positivo, ou seja, quando o câncer não está presente no organismo, mas o primeiro resultado diz que sim.
Fonte: Globo.com
Lupus Eritematoso Sistemico
Lúpus Eritematoso Sistêmico
Introdução
As doenças autoimunes são um tipo de
desordem imunológica caracterizada pela diminuição da tolerância aos
componentes do próprio organismo.
Para que uma doença seja caracterizada
como autoimune três requisitos devem estar presentes:(1) presença de reação
autoimune;(2) evidências de que esta reação não é secundária aos danos
teciduais, como os resultantes de uma infecção;(3) a ausência de outra causa
bem definida para a doença.
Diversos estímulos promovem
a ativação de linfócitos auto-reativos. Os seguintes mecanismos são sugeridos
para explicar a relação entre infecções e autoimunidade: Up-regulation da
expressão de co-estimuladores em células apresentadoras de antígeno,mimetismo
molecular,as infecções podem causar dano tecidual e liberação de antígenos
próprios que sofrem alteração estrutural e ativam células T.
Etiologia
O lúpus eritematoso
sistêmico (LES) é uma doença inflamatória crônica, autoimune, que apresenta
grande variação de etiopatogenia, manifestações clínico-laboratoriais e
prognósticos. De modo geral, há predomínio de acometimento cutâneo e articular
e alterações imunológicas com formação excessiva de múltiplos
auto-anticorpos.
Sua etiologia ainda não
está completamente elucidada, sendo provavelmente multifatorial e variável para
diferentes indivíduos. Acredita-se que seja necessária a predisposição genética
interagindo com fatores hormonais, ambientais e infecciosos, que levem à quebra
da tolerância imunológica com formação de auto-anticorpos contra antígenos
diversos. Foram identificados antígenos contra uma gama de componentes
nucleares e citoplasmáticos que não são específicos nem para órgãos nem para a
espécie. Além disso, um terceiro grupo de anticorpos é direcionado contra
antígenos da superfície celular das células do sangue. Estudos de relação
causal têm identificado como desencadeantes a infecção pelo vírus Epstein Barr,
a exposição à radiação ultravioleta e contextos de variação hormonal como
menarca e gravidez, por exemplo. Alguns antígenos leucocitários humanos (HLA)
se associam a risco aumentado de LES. Há maior risco de produção de alguns
auto-anticorpos na presença dos alelos DQB1 e DQA1. A quebra da tolerância no
LES deve envolver mecanismos como exposição de antígenos nucleares e sua apresentação
a linfócitos que desencadeiam ativação de clones autorreativos, particularmente
da resposta humoral, redução da depuração de imunocomplexos e de restos
celulares provenientes de apoptose e diminuição da atividade de linfócitos
supressores. A prática clínica identifica com grande freqüência o início do
quadro ou sua exacerbação intimamente relacionada a grandes perdas e outros
tipos de estresse emocional, cujos mecanismos envolvem inter-relações do
sistema neuropsíquico e imunoendócrino ainda pouco esclarecidos.
Epidemiologia
Incidência:
É muito variável:
-
Varia
de 3,7 a 5,5 por 100.000 habitantes;
-
Em
Natal (RN), identificou-se incidência de 8,7/100.000 habitantes no ano de 2000,
o que sugere a associação da exposição solar com o LES. A radiação
ultravioleta, que comumente exacerba manifestações cutâneas do LES, também pode
ter um papel no seu desencadeamento.
-
Prevalência
O LES é uma doença de
distribuição universal, cuja prevalência tem aumentado nos últimos anos,
provavelmente, em virtude do aprimoramento nas técnicas de diagnóstico, com
maior precocidade na identificação e aumento da sobrevida.
-
Na
população em geral, é de 40-50 casos por 100.000 pessoas;
-
Há
uma preponderância na população feminina, na proporção de 9:1;
-
Nos
EUA, é mais freqüente em mulheres e em negros (chance de 1:250 em mulheres
negras americanas) e, na faixa etária de 15 a 40 anos;
-
A
associação familiar é comum e a coincidência de gêmeos idênticos é de 30%.
Patogenia do Lúpus Eritematoso Sistêmico (LES)
A patogenia do LES está
relacionada com os seguintes processos:
-
Defeito
na remoção de células apoptóticas, o que permite a estimulação do sistema
imunológico por apresentação de autoantígenos.
-
Perda
da autolerância imunológica, condição em que o sistema imunológico do indivíduo
passa a responder a antígenos próprios.
-
Ativação
policlonal de células B dependente de células T auxiliares antígeno-
específicas que passam a produzir anticorpos que lesionam o tecido.
-
Produção
de auto-anticorpos, particularmente anticorpos antinucleares (ANAS). Os ANAS
são direcionados contra diversos antígenos nucleares e são agrupados em quatro
categorias: anticorpos contra histonas, anticorpos contra DNA, anticorpos
contra proteína não histonas ligadas ao RNA, e anticorpos contra antígenos
nucleolares. Os auto-anticorpos tem alta especificidade e afinidade e pertencem
a classe IgG, eles promovem a lesão tecidual que fornece mais auto-antigenos,
perpetuando a resposta auto-imune.
-
Diminuição
da remoção de imunocomplexos: a falta do complemento pode prejudicar a remoção
de imunocomplexos circulantes e de células apoptóticas pelo sistema
fagocitário.
A maior parte das lesões
viscerais no LES decorre da formação de imunocomplexos durante a
Hipersensibilidade do tipo III. Neste tipo de hipersensibilidade há formação de
complexos antígeno-anticorpo na circulação, caso estes não sejam devidamente
removidos podem se depositar em diversos locais do corpo: glomérulos renais,
articulações, pele, coração, superfícies serosas e pequenos vasos sanguíneos.
Uma vez depósitos nos
tecidos, os complexos iniciam uma reação inflamatória por dois mecanismos: (1)
ativação da cascata do complemento- pela produção de fatores quimiotáticos, que
direcionam a migração de leucócitos e monócitos e liberação de anafilotoxinas,
que aumentam a permeabilidade vascular; e (2) ativação de neutrófilos e
macrófagos por meio dos receptores Fc.
Os imunocomplexos podem
promover também a agregação plaquetária o que amplifica o processo inflamatório
e inicia a formação de microtrombos. A lesão inflamatória decorrente é
denominada vasculite.
Sinais
clínicos:
As lesões mais freqüentes são de natureza
inflamatória e devem-se à deposição ou formação in situ de imunocomplexos em
tecidos, seguidas de ativação do complemento. O padrão inicial se caracteriza
por sintomas inespecíficos como mal-estar, fadiga,febre baixa, perda de peso,
linfadenomegalia. A composição do quadro pode variar bastante de um paciente
para outro. Pode acometer vários órgãos de forma cíclica ou persistente, pode
ser de forma aguda ou crônica, com períodos de remissão e exacerbação.
Comprometimentos:
1)
Cutâneo: mais comum
eritema malar (característica lesão em asa de borboleta na face), fortemente
associada à fotossenssibilidade; Lesões agudas são eritematosas, maculares,
papulares ou mesmo bolhosas, predominantes em áreas expostas ao sol. Lesões
discóides, uma forma de lúpus cutâneo crônico, iniciam-se por pápulas ou placas
eritematosas que se tornam espessadas, aderidas, com centro hipopigmentado.
Alopecia.
2)
Articular: Cerca de
90% dos pacientes se apresentam com dor articular, alguns com artrite (mãos,
punhos e pés).
3)
Hematológico: A anemia hemolítica é
um critério diagnóstico. Ao longo da evolução mais da metade dos casos cursarão
com leucopenia e linfopenia.
4)
Renal:
Glomerulonefrite de intensidade e gravidade variadas, causada pela deposição de
imunocomplexos nos glomérulos renais. Proteinúria, cilindrúria anormal ou pelo
aumento dos níveis séricos de creatinina.
5)
Neurológico: tem
apresentação variável sendo classificada pelo Colégio Americano de Reumatologia
em dois tipos de manifestações neuropsiquiátricas: Comprometimento do SNC e
Comprometimento do SNP
6)
Serosas: Dor torácica,
derrame pleural e alterações geralmente assintomáticas no pericárdio.
7)
Pulmonar: A pneumonite
lúpica se manifesta por dispneia, tosse que pode ser produtiva, febre,
eventualmente cianose. A radiografia mostra infiltrado alveolar difuso. A
hemorragia alveolar é extremamente grave e pode ser maciça, mas é rara.
8)
Cardíaco: Pode ocorrer
endocardite, com insuficiência da valva mitral. O diagnóstico clínico de
miocardite é incomum, pode evoluir para insificiência cardíaca. A aterosclerose
é a causa mais frequente de comprometimento coronário, que tem sido relacionada
à crônica atividade inflamatória de pacientes lúpicos.
9)
Vascular: As
vasculites podem acometer vasos de diferentes calibres, principalmente os
pequenos, podendo causar manifestações diversas relativas a isquemia e necrose
tecidual em determinados órgãos, sobretudo, mucosa oral ou nasal e na pele,
mais na extremidade dos dedos
10) Digestório: um quinto dos pacientes apresenta
hepatomegalia ou esplenomegalia. Há quadros que de abdome agudo em deve se
lembrar de vasculite mesentérica. Evolução para peritonite crônica é muito
rara. Pancreatite aguda pode ocorrer em raros casos. Dor abdominal, náuseas e
vômitos são mais frequentemente observados como efeitos adversos da terapia
medicamentosa.
11) Ocular: A conjuntivite e a vasculite retininana são
os acometimentos mais freqüentes.
12) Endócrino: Irregularidades no ciclo menstrual podem
ocorrer em períodos de inflamação sistêmica, mas a fertilidade não está
alterada. A menopausa precoce é descrita em pacientes com LES, possivelmente
relacionada à presença de anticorpos contra-antígenos ovarianos.
13) Muscular: redução de massa magra em pacientes com
LES, decorrente do descondicionamento físico e da corticoterapia.
Diagnóstico:
São de grande utilidade os critérios do
Colégio Americano de Reumatologia para a classificação do LES que exigem a
presença de quatro ou mais itens de uma lista de 11, apresentam sensibilidade e
especificidade em torno de 96% e tiveram sua última modificação em 1997.
1. Eritema malar
1. Eritema malar
2. Lesão discóide
3. Fotossensibilidade: exantema (erupção)
cutâneo decorrente de exposição à luz solar
4. Úlceras orais/nasais: usualmente são
indolores.
5. Artrite: caracterizadas por dor e edema ou derrame articular
5. Artrite: caracterizadas por dor e edema ou derrame articular
6. Serosite: pleuris (atrito pleural
auscultado por médico ou imagem de derrame pleural) ou pericardite (atrito
pericárdico ou imagem de derrame pericárdico).
7. Comprometimento renal: proteinúria persistente ou cilindrúria anormal.
8. Alterações neurológicas: convulsão ou psicose
7. Comprometimento renal: proteinúria persistente ou cilindrúria anormal.
8. Alterações neurológicas: convulsão ou psicose
9. Alterações hematológicas: anemia
hemolítica ou leucopenia ou linfopenia ou plaquetopenia.
10. Alterações imunológicas: Ac anti-DNA nativo ou anti-Sm ou Ac antifosfolípide baseado em: a) níveis anormais de IgG ou IgM anticardiolipina b) teste positivo para anticoagulante lúpico ou teste falso-positivo para sífilis, por no mínimo seis meses.
11. Anticorpos antinucleares: título anormal de Ac antinuclear por imunofluorescência indireta.
10. Alterações imunológicas: Ac anti-DNA nativo ou anti-Sm ou Ac antifosfolípide baseado em: a) níveis anormais de IgG ou IgM anticardiolipina b) teste positivo para anticoagulante lúpico ou teste falso-positivo para sífilis, por no mínimo seis meses.
11. Anticorpos antinucleares: título anormal de Ac antinuclear por imunofluorescência indireta.
FATORES
ANTINUCLEARES (FAN): Método: Imunofluorescência indireta. Indicação: teste de triagem para doenças auto-imunes e lúpus
eritematoso sistêmico (LES)
Exames complementares:
hemograma, creatinina, coagulograma, urina tipo I, radiografia do tórax,
dosagem séricas de proteínas do sistema complemento.
Tratamento
Informação, bem como o
apoio psicológico ao paciente e familiares, de forma que os pacientes possam
aderir ao tratamento e a grande maioria terá boa evolução e qualidade de vida.
O tratamento se inicia
com medidas gerais.
A atividade física
(controle de sintomas depressivos, redução de fadiga, dores difusas, distúrbio
do sono e melhora do condicionamento físico).
A alimentação
equilibrada, que garante aporte proteico e cálcio, que evita excessos no
consumo de sal, carboidratos e lipídios.
A proteção contra luz
solar e outras fontes de irradiação ultravioleta (UV), é capaz de prevenir
ativação da doença.
Tratamento Medicamentoso
Antimaláricos: agem
como poupador de corticoide e também colabora no controle da dislipidemia e na
redução da hipercoagulabilidade, comumente presente.
AINH: habitualmente
são efetivos no controle de manifestações articulares leves e serosites.
Corticosteroides
Essa medicação tem
diversas indicações no tratamento da LES e deve ser administrada em dose baixa para
controle da doença,
Talidomida: Indicada
para lesões cutâneas não responsivas ao tratamento usual.
Imunoglobulina
intravenosa: Indicada para plaquetopenia grave.
Anticoagulantes
Imunossupressores
Prognóstico
Sinais clínicos podem
prover informações prognósticas sobre envolvimento geral e de órgãos
principais.
Nas últimas décadas a
sobrevida no LES aumentou muito – sendo por volta de 85% em dez anos, mas
variam de acordo com condições sócio-econômicas e outros fatores.
A mortalidade tem
padrão bimodal – nos primeiros anos ocorre principalmente por infecção, seguida
de grave atividade renal ou em SNC após vários anos, por doenças
cardiovasculares associadas a arteriosclerose, relacionada parcialmente à
corticoterapia, mas também à inflamação crônica.
Empiema
EMPIEMA
Consiste na presença de pus na
cavidade pleural, com mais de 100000 neutrófilos/mm3. Em geral, o
volume acumulado é pequeno. A grande maioria dos empiemas é secundária a
infecção pulmonar. Entre outras causas citam-se os empiemas pós-cirúrgicos e,
mais raramente, traumatismos, perfuração esofágica, pneumotórax espontâneo,
abscesso subdiafragmático ou hepático. Na evolução do empiema, podem se formar
aderências fibrosas que resultam em coleções locais chamadas empiema septado. Quando o processo
inflamatório crônico é muito intenso, os fibroblastos jovens apresentam
aparência atípica. A presença de maturação celular nas camadas profundas da
pleura demonstra seu caráter reacional da lesão.
Carcinoma Broncopulmonar
CARCINOMA BRONCOPULMONAR
O câncer do pulmão constitui
importante problema de saúde, sendo uma das causas mais comuns de morte por
neoplasias. Sua incidência vem crescendo nos últimos 50 anos, coincidindo com
um aumento paralelo na produção de tabaco e no consumo de cigarros. Em
mulheres, além do aumento notável da sua incidência nos últimos anos, a taxa de
mortalidade por carcinoma de pulmão continua crescendo. Independentemente do
tipo histológico e em ambos os sexos, o carcinoma pulmonar predomina entre 35 e
75 anos, com pico em 55-65 anos de idade. No Brasil, prevalência e mortalidade
são altas.
Existe grande heterogeneidade
citológica e histológica nas neoplasias pulmonares. Assim, o câncer de pulmão
pode ser dividido em quatro tipos histológicos principais.
Etiopatogênese
Assim como ocorre com muitas
outras neoplasias, a gênese do câncer de pulmão resulta da interação de fatores
ambientais com alterações genômicas múltiplas. O fumo em associação com outras
substâncias é responsável por cerca de 80% dos casos de câncer do pulmão no
homem e 75% na mulher. Parece que as mulheres são mais suscetíveis aos efeitos
dos carcinógenos do fumo do que os homens.
Estudos recentes associam o fumo
com a expressão do gene RAS, sendo que outros genes como MYC e HER-2-NEU também
podem estar envolvidos. O gene supressor de tumor mais comum no câncer humano é
o p53, cuja expressão anormal favorece o crescimento descontrolado da célula.
O risco de desenvolver câncer do
pulmão em indivíduos com história familial é 2,5 vezes maior do que na
população geral.
Tipos:
1.
Carcinoma
epidermoide: é o mais frequente, o menos heterogêneo morfologicamente e o mais
associado ao tabagismo. É mais comum em homens. O tumor tende a aparecer nos
grandes brônquios. Seu crescimento é mais lento do que os demais; suas
metástases são para os linfonodos regionais, sendo tardia a disseminação
hematogênica. É o de melhor prognóstico.
Macroscopicamente,
pode se apresentar desde pequena tumoração endobrônquica obstrutiva até as
grandes massas cavitárias. A neoplasia tende a invadir a cartilagem, o
parênquima pulmonar e os linfonodos. É facilmente visível à endoscopia.
Histologicamente,
o tumor é formado por células epiteliais contendo pontes intercelulares e
ceratinização individual ou sob a forma de pérolas córneas. Outro sinal de
diferenciação escamosa é a presença de ninhos sólidos com células de núcleo
hipercromático. A mucosa adjacente apresenta áreas de metaplasia escamosa,
displasia ou carcinoma in situ. A
lesão é usualmente envolvida por estroma. Quanto ao grau de diferenciação, o
tumor pode ser: (1) bem diferenciado, com características de células escamosas;
(2) moderadamente diferenciado, características intermediárias; (3) pouco
diferenciado, com células pouco discerníveis e indiferenciadas.
2. Adenocarcinoma:
mais frequente em mulheres e sua associação com o tabagismo é pouco importante.
Localiza-se na periferia dos pulmões e muitas vezes envolve a pleura visceral e
frequentemente se associa a lesões destrutivas ou cicatrizes no parênquima
pulmonar ou a hiperplasia dos pneumócitos. A maioria se origina nas vias aéreas
periféricas nas células de Clara ou nos pneumócitos do tipo II.
Macroscopicamente,
trata-se de lesão com superfície homogênea, sólida e de coloração marfim, às
vezes com aspecto translúcido.
Microscopicamente,
é neoplasia maligna com diferenciação glandular e produção de mucina, podendo
ser dividido nos padrões acinar, papilífero, carcinoma sólido com formação de
muco e carcinoma bronquíolo-alveolar. Também pode ser dividido em bem,
moderadamente ou pouco diferenciado.
3. Carcinoma
bronquíolo-alveolar: aparece em indivíduos jovens até idosos, afetando
igualmente os dois sexos.
O tumor
apresenta-se sob duas formas: (1) localizada, como nódulo periférico de
crescimento lento e melhor prognóstico; (2) difusa, como pequenos nódulos que
acometem grandes áreas do pulmão, às vezes bilateralmente. O prognóstico é pior
e a morte ocorre por insuficiência respiratória. O tumor é formado por células
cúbicas ou prismática, situadas ao longo de alvéolos e bronquíolos.
4. Carcinoma
de células grandes: tipo menos frequente, mas de comportamento altamente
agressivo com evolução rápida para o óbito.
Lesão
periférica, subpleural, não se associa a segmento brônquico e tende a formar
grandes massas com áreas de necrose e hemorragia. Ao microscópio eletrônico, as
células apresentam diferenciação escamosa ou glandular.
5. Carcinoma
de células pequenas: predomina na sexta ou sétima década de vida, mais comum
entre homens e possui grande associação ao tabagismo. É altamente maligno e o
de pior prognóstico entre os tumores pulmonares. Dá metástases com frequência,
sobretudo para a medula óssea. Pode secretar diversos hormônios, resultando em
diversas síndromes paraneoplásicas.
Possui
localização central, formado por células pequenas e uniformes. As células
tendem a se apresentar separadas ou levemente coesas, com pequena quantidade de
estroma. Pode haver focos de necrose.
6. Tumor
carcinoide: derivado de células neuroendócrinas do pulmão. É mais comum até os
40 anos de idade, igual em ambos os sexos e não se relaciona ao tabagismo.
Tem localização
central ou periférica e se apresenta como lesão submucosa que se projeta na luz
brônquica. É formado por células uniformes e pequenas. Pode ser típico, que
possui o melhor prognóstico, ou atípico.
Hipertensão Pulmonar
HIPERTENSÃO PULMONAR
Em condições normais, a pressão
arterial pulmonar corresponde a um sexto da pressão arterial sistêmica. Por
isso, os vasos pulmonares têm paredes finas e maiores lumens do que os vasos de
igual tamanho da circulação e sistêmica e reagem a situações de hipóxia com
vasoconstrição. O preço dessa manobra em indivíduos em situação de hipóxia crônica
com vasodilatação pulmonar persistente é o aumento da resistência vascular
pulmonar e a consequente sobrecarga cardíaca direita.
Em adultos, a pressão arterial
pulmonar em repouso varia de 10 a 14 mmHg. Valores acima de 25 mmHg no repouso
e 30 mmHg no exercício são considerados patológicos e diagnósticos de
hipertensão pulmonar. Valores acima de 40 mmHg definem hipertensão pulmonar
grave.
A etiologia da hipertensão
pulmonar é variada e nem sempre conhecida.
Em poucos pacientes não se
identifica um fator causal para a hipertensão pulmonar, sendo chamada de hipertensão pulmonar idiopática ou primária. A doença que acomete mulheres
na faixa etária de 20 a 40 anos é geralmente esporádica e apenas 6% têm a forma
familial.
Na maioria dos casos, a
hipertensão pulmonar é secundária a causas diversas:
1. cardiopatias
congênitas;
2. tromboembolia
pulmonar recorrente;
3. doença
pulmonar veno-oclusiva, caracterizada por desenvolvimento de fibrose intimal e
estreitamento da luz de vênulas e veias pulmonares;
4. insuficiência
cardíaca esquerda;
5. doença
pulmonar obstrutiva crônica;
6. outras
condições como uso de certos fármacos, fatores dietéticos, doenças autoimunes,
hipertensão porta, cirrose hepática e infecção pelo HIV.
Nas formas idiopática e familial,
são encontradas mutações em dois genes (BMPR-2 e ALK-1) que codificam proteínas
da família do receptor do TGF-β.
Na hipertensão secundária,
agressão ao endotélio parece ser o mecanismo desencadeador dos eventos que
culminam em hipertensão arterial. As principais alterações são vasoconstrição,
trombos e proliferação de células endoteliais e musculares.
Clinicamente, os paciente evoluem
com insuficiência respiratória progressiva e hipertrofia ventricular direita.
Em 80% dos casos, ocorre óbito 2 a 5 anos após o diagnóstico por cor pulmonale descompensado,
tromboembolia ou pneumonia.
Aspectos morfológicos
Os achados variam de acordo com a
duração e a intensidade de hipertensão pulmonar. As lesões são progressivas com
o tempo e compõem um espectro que pode chegar até a chamada arteriopatia pulmonar plexogênica.
A lesão inicial consiste em
hipertrofia da média e muscularização das pequenas arteríolas do parênquima
pulmonar distal. Mais tarde, surge fibrose concêntrica laminar na íntima, que
pode levar a obstrução do vaso. Nos casos mais graves, ocorre necrose
fibrinoide da parede arterial e posterior formação das lesões plexiformes, que
consistem em dilatação focal da artéria, ficando a luz preenchida por tufos
capilares. Nos casos mais graves pode haver aterosclerose nos grandes ramos da
artéria pulmonar. A presença de êmbolos está relacionada com a etiologia
tromboembólica da hipertensão pulmonar.
Embolia Pulmonar
EMBOLIA PULMONAR
Os vasos pulmonares recebem
sangue venoso de todo o organismo, dentro de um sistema que se estreita
progressivamente à medida que se aproxima do território alveolar. Partículas
sólidas, líquidas ou gasosas trafegando arterial (êmbolos) impactam-se em algum
segmento do leito vascular pulmonar, caracterizando o quadro de embolia
pulmonar. Pode ser de origem trombótica, gordurosa ou gasosa.
Na tromboembolia pulmonar o
diagnóstico clínico nem sempre é preciso. Entretanto é a segunda causa mais
frequente de doença cardiovascular aguda, depois de infarto agudo do miocárdio.
Sua incidência aumenta com a idade. Em muitos paciente, ela é grave e fatal; em
10% dos casos, o óbito ocorre em até 1 h, sendo, portanto importante causa de
morte súbita. É a terceira causa de óbito cardiovascular
Nos pulmões, obstrução arterial é
quase sempre de origem embólica. Em cerca de 80% dos casos, os trombos que
originam êmbolos pulmonares são formados em veias profundas dos membros
inferiores (trombose venosa profunda); menos frequentemente, os trombos estão
no coração direito ou em cateteres venosos centrais. Trombos venosos são
reconhecidos pela síndrome de Virchow: hipercoagulabilidade, estase e lesão
endotelial.
Entre os fatores de risco
passíveis de prevenção, obesidade, tabagismo e hipertensão arterial sistêmica são
os mais importantes. Prevenção da trombose venosa profunda é a melhor forma de
prevenir a embolia pulmonar.
Embolia pulmonar se deve também
a: (1) bolhas de gás no sangue; (2) corpos estranhos; (3) partículas de
gordura; (4) líquido amniótico, após trabalho de parto prolongado; (5) células
neoplásicas.
As repercussões fisiopatológicas
variam desde alterações subclínicas até a morte súbita. As principais
consequências são: (1) prejuízo da perfusão pulmonar; (2) sobrecarga do coração
direito; (3) isquemia do parênquima. A gravidade do evento embólico depende
tanto de fatores do indivíduo como das características dos êmbolos.
As principais manifestações são:
1.
morte súbita por: (a) hipóxia aguda e/ou colapso
circulatório, quando a embolia oblitera grandes ramos da artéria pulmonar; (b)
falência aguda do ventrículo direito (cor
pulmonale agudo);
2.
infarto pulmonar: nos ramos médios da artéria
pulmonar ou nos casos em que há doença cardiopulmonar preexistente;
3.
hipertensão pulmonar, associada a episódios
recorrentes de embolia.
quinta-feira, 15 de novembro de 2012
Gênero Leishmania
Gênero
Leishmania
O
gênero Leishmania, agrupa cerca de 26
espécies de protozoários unicelulares heteroxenos, encontradas nas formas promastígota e paramastígota, flageladas livres ou aderidas ao trato
digestivo dos hospedeiros invertebrados, e amastígota, sem flagelo livre,
parasito intracelular. A espécie envolvida na infecção definirá a evolução
clínica do paciente. A reprodução ocorre por divisão binária simples em ambos
os hospedeiros.
Os
hospedeiros vertebrados incluem uma grande variedade de mamíferos. Embora as
infecções por esses parasitos sejam mais comuns nos roedores e canídeos, são
conhecidas também entre edentados, marsupiais, procionídeos, ungulados
primitivos, primatas e, entre estes, o homem.
Como
hospedeiros invertebrados são identificados, exclusivamente, fêmeas de insetos hematófagos
conhecidos como flebotomíneos. A
transmissão ocorre por mecanismo complexo, através da picada do inseto
infectado, no momento da hematofagia.
MORFOLOGIA
As
amastigotas,. Apresentam núcleo grande e arredondado, ocupando as vezes
um terço do corpo do parasito, e cinetoplasto em forma de um pequeno bastonete,
além de vacúolos que podem ou não ser visualizados. Não há flagelo livre. Nas diferentes espécies de Leishmania, a membrana apresenta uma invaginação
na região anterior do corpo do parasito formando a bolsa flagelar, onde se
localiza o flagelo.
As
formas flageladas, promastígotas são encontradas no trato digestivo do
hospedeiro invertebrado. O núcleo é arredondado ou oval. O cinetoplasto, em forma
de bastão, localiza-se entre a extremidade anterior e o núcleo
As
paramastígotas são pequenas e arredondadas ou ovais. O flagelo é curto,
exterioriza se na região anterior do corpo e sua extremidade pode estar aderida
a superfície do trato digestivo do vetor. O núcleo mantém-se na posição mediana
do parasito e o cinetoplasto é paralelo ou
ligeiramente posterior ao núcleo.
As
promastígotas metacíclicas são as formas infectantes para os
hospedeiros vertebrados. Possuem mobilidade intensa e são encontrados livres
nas porções anteriores do trato digestivo do inseto.
CICLO
BIOLÓGICO
Os
hospedeiros vertebrados são infectados quando formas promastígotas metacíclicas
são inoculadas pelas fêmeas dos insetos
vetores, durante o repasto sanguíneo.
A
saliva do inseto é inoculada neste ambiente e exerce papel importante como
anticoagulante, vasodilatadora e antiagregação de plaquetas, favorecendo o
fluxo de sangue e a linfa intersticial para o alimento. Além destes efeitos, sabe-se que fatores presentes na saliva de
flebotomíneos têm ação quimiotática para
monócitos e imunorregulador, com capacidade de interagir com os macrófagos,
aumentando sua proliferação e impedindo a ação efetora destas células na
destruição dos parasitos.
As
formas promastígotas metacíclicas são
resistentes a lise pelo complemento. As formas promastígotas podem ainda
interagir com outras proteínas do soro para ativar o complemento, facilitando a
adesão a membrana do macrófago.
A
internalização de Leishmania se faz
através da endocitose mediada por
receptores na superficie do macrófago. A rápida transformação em amastígotas é
outra forma de evadir ao ataque do hospedeiro.
A amastígota inicia o processo de
sucessivas multiplicações. Na ausência do controle parasitário pela célula
hospedeira, esta se rompe e as amastígotas liberadas serão, por mecanismo
semelhante, internalizadas por outros macrófagos.
A
infecção para o hospedeiro invertebrado ocorre quando da ingestão, no momento do repasto sanguíneo em
indivíduo ou animal infectado, das formas
amastígotas que acompanham o sangue e/ou a linfa intersticial. No intestino do
inseto, as amastígotas se transformam em (1) promastígotas, (2) paramastígotas
e (3) promastígotas metacíclicos.
Leishmaniose
Tegumentar Americana
INTRODUÇÃO
Definição
A leishmaniose tegumentar americana
(LTA) é uma doença de caráter zoonótico
que acomete o homem e diversas espécies de animais silvestres e domésticos,
podendo se manifestar através de diferentes formas clínicas. É considerada uma enfermidade polimórfica e
espectral da pele e das mucosas. As principais manifestações observadas
são:
-
a forma cutânea localizada é caracterizada por lesões
ulcerosas, indolores, únicas ou múltiplas;
-
a forma cutaneomucosa é caracterizada por lesões
mucosas agressivas que afetam as regiões nasofaríngeas;
-
a forma disseminada apresenta múltiplas úlceras
cutâneas por disseminação hematogênica ou linfática;
-
a forma difusa com lesões nodulares não-ulceradas.
AGENTE
ETIOLÓGICO
A
leishmaniose tegumentar americana é uma doença causada por parasitos do gênero Leishmania.
Os
hospedeiros vertebrados incluem grande variedade de mamíferos: roedores,
edentados (tatu, tamanduá, preguiça), marsupiais (gambá), canídeos e primatas,
incluindo o homem. A dispersão da doença nas mais variadas regiões do Brasil
tem como fator a grande variedade dos hospedeiros invertebrados.
Os
hospedeiros invertebrados são pequenos insetos
da subfamília Phlebotominae, gênero Lutzomya.
Nestes insetos ocorre parte do ciclo biológico do parasito. No caso da leishmaniose
tegumentar americana, a principal espécie envolvida é a Lutzomya intermedia.
O
processo de reprodução do agente etiológico é feito por divisão binária.
Atualmente
são conhecidas várias espécies de Leishmania
que causam a leishmaniose tegumentar. As espécies que provocam doença no homem,
particularmente as que ocorrem no Brasil são:
- Leishmania (Viannia) braziliensis;
- Leishmania (Viannia) amazonensis;
MORFOLOGIA
Formas
amastigotas. São ovóides ou
esféricas. Distingue-se a membrana citoplasmática e o citoplasma onde podemos
encontrar vacúolos, um único núcleo que apresenta-se esférico ou ovóide
disposto em geral em um dos lados da célula e o cinetoplasto, situado na
maioria das vezes próximo do núcleo; não há flagelo livre.
Formas
promastigotas. São formas alongadas em cuja região anterior
emerge um flagelo livre. No citoplasma observam-se granulações azurófilas e
pequenos vacúolos. O núcleo assemelha-se ao existente na forma amastígota;
situase na região anterior, variando bastante na sua posição.
Formas
paramastigotas. Apresentam-se ovais
ou arredondadas com o cinetoplasto margeando o núcleo ou posterior a este e um pequeno
flagelo livre. São encontradas aderidas ao epitélio do trato digestivo do
vetor.
CICLO
BIOLÓGICO
Durante
o processo de alimentação do flebotomíneo é que ocorre a transmissão do parasito.
Na tentativa da ingestão do sangue, as formas promastígotas metacíclicas são
introduzidas no local da picada. Dentro de quatro a oito horas, estes
flagelados são interiorizados pelos macrófagos teciduais. A saliva do
flebotomíneo possui neuropeptídeos vasodilatadores que atuam facilitando a
alimentação do inseto e ao mesmo tempo imunossuprimindo a resposta do
hospedeiro vertebrado. O parasito é fagocitado pelos macrófagos e envolto pelo vacúolo
fagocitário. Rapidamente as formas promastígotas se transformam em amastígotas
que são encontradas 24 horas após a fagocitose. Dentro do vacúolo fagocitário,
as amastígotas estão adaptadas ao novo meio fisiológico e resistem a ação
destruidora dos lisossomas, multiplicando-se por divisão binária até ocupar
todo o citoplasma. Esgotando-se a resistência celular, a membrana do macrófago
se rompe liberando as amastígotas no tecido, sendo novamente fagocitadas,
iniciando no local uma reação inflamatória.
A
infecção do inseto ocorre quando a fêmea pica o vertebrado para exercer o
repasto sanguíneo e juntamente com o sangue ingere macrófagos parasitados por
formas amastígotas. Durante o trajeto pelo trato digestivo anterior, ou ao
chegarem no estômago, os macrófagos se rompem liberando as amastígotas. Essas
sofrem uma divisão binária e se transformam rapidamente em promastígotas, que também por processos sucessivos de divisão
multiplicam-se ainda no sangue ingerido,
que é envolto por uma membrana
peritrófica secretada pelas células do estômago do inseto. Após a digestão do
sangue entre o terceiro e o quarto dias, a membrana peritrófica se rompe e as
formas promastígotas ficam livres. As promastígotas permanecem reproduzindo por
divisão binária, transformam-se em paramastígotas
e, depois, em promastígotas metacíclicas,
as formas infectantes.
MECANISMO
DE TRANSMISSÃO
A
transmissão ocorre pela picada de
insetos hematófagos pertencentes ao gênero Lutzomyia,
conhecidos no Brasil por birigui, mosquito-palha e tatuquira, entre outros.
Ao
exercer o hematofagismo, a fêmea do flebotomíneo corta com suas mandíbulas o
tecido subcutâneo logo abaixo da epiderme, formando sob esta um afluxo de
sangue, onde são inoculadas as formas promastígotas metacídicas.
INTERAÇÃO
PARASITO-CÉLULA HOSPEDEIRA
Com
relação aos elementos sorológicos do hospedeiro, destacam-se as proteínas do sistema do complemento, os anticorpos
(IgG) e a fibronectina.
A
saliva contribui efetivamente na infecciosidade das formas promastígotas, por
meio de substância vasodilatadora. Essa substância imunossupressora parece
inibir a apresentação de antígenos de Leishmania
pelos macrófagos e a secreção de citocinas tipo I (IL12 e INFγ). Desta
forma,
citocinas tipo II (IL4 e ILI O) agem
suprimindo a resposta imune celular favorecendo o sucesso da
infecção.
Os
anticorpos da classe IgG e as fibronectinas participam do processo de adesão
das promastígotas infectantes ao macrófago por meio de receptores para porção
Fc das IgG. As diversas espécies de Leishmania
são capazes de ativar o complemento tanto pela via clássica como pela via alternativa.
Os fatores do complemento favorecem a fagocitose e o complexo lítico final do
complemento (C5-9) é capaz de aderir a superfície dos promastígotas e provocar
a lise dessas formas. Entretanto, os LPs
(lipofosfossacarídeos) dos parasitos interferem na inserção do complexo C5-9,
provavelmente por impedimento estérico produzido pelo espessamento da LPG
(lipofosfoglicano).
No
interior do fagossoma as promastígotas transformam-se em amastígotas que
sobrevivem e se multiplicam dando início à infecção. Neste papel de
sobrevivência, destaca-se a LPG.
ASPECTOS
IMUNOLÓGICOS
Uma
resposta celular e humoral contra o parasito é desenvolvida pelo sistema imune
do homem. A resposta imunológica é modulada por linfócitos T CD+:
Thl (resistência – resposta celular – representam as formas mais brandas) e Th2
(suscetibilidade – resposta humoral).
A
leishmaniose cutâneo-difüsa está correlacionada com a resposta do tipo Th2, na
qual existe uma infiltração dérmica de macrófagos, habitualmente vacuolizados,
repletos de amastígotas e com escassez de linfócitos, caracterizando um padrão
de suscetibilidade em humanos. Nos casos
de leishmaniose cutâneo e cutaneomucosa, os níveis de anticorpos são baixos ou
discretamente aumentados quando ocorre acometimento de mucosa. Após cura
clínica, os títulos de anticorpos decrescem, deixando de ser detectados alguns
meses após a cura em alguns casos.
PATOGENIA
No
inicio da infecção, as formas promastígotas são inoculadas na derme durante o
repasto sanguíneo do flebotomineo. As
células destruídas pela probóscida do inseto e a saliva inoculada atraem para a
área células fagocitárias mononucleares, os macrófagos e outros lecócitos.
Certos macrófagos são capazes de destmir os parasitos diretamente, enquantos
outros necessitam ser estimulados. Somente macrófagos fixos (histiócitos) não-estimulados
são hábeis para o estabelecimento da infecção.
Ao serem fagocitadas, as promastígotas transformam-se em amastígotas e iniciam
reprodução por divisões binárias sucessivas; mais macrófagos são atraídos ao
sítio, onde se fixam e são infectados. A lesão inicial é manifestada por
um infiltrado inflamatório composto
principalmente de linfócitos e de macrófagos na derme, estando estes últimos
abarrotados de parasitas.
Período
de incubação: varia de duas semanas a
três meses.
Evolução
As
lesões iniciais são semelhantes, independentemente da espécie do parasito. Esta
forma inicial pode regredir espontaneamente após um breve curso abortivo, pode
permanecer estacionária ou evoluir para um nódulo dérmico chamado
"histiocitoma", localizado sempre no sítio da picada do vetor
infectado. Nos estágios iniciais da infecção, histologicamente a lesão é caracterizada
pela hipertrofia do extrato córneo e da papila, com acúmulo de histiócitos nos
quais o parasito se multiplica. Gradualmente forma-se um infiltrado celular
circundando a lesão, consistindo principalmente em pequenos e grandes
linfócitos, entre os quais alguns plasmócitos. Como resultado, forma-se no
local uma reação inflamatória do tipo tuberculóide. Ocorre necrose resultando
na desintegração da epidenne e da
membrana basal que culmina com a formação de uma lesão úlcero-crostosa. Após a
perda da crosta, observa-se uma pequena cera com bordas ligeiramente salientes
e fundo recoberto por exsudato seroso ou seropurulento. Esta lesão progride,
desenvolvendo-se em uma típica úlcera leishmaniótica. Trata-se de uma úlcera de
configuração circular, bordos altos cujo fundo é granuloso, de cor
vermelha intensa, recoberto por exsudato
seroso ou seropurulento, dependendo da presença de infecções secundárias.
Seguido
a um tratamento com sucesso, forma-se no local, em substituição a úlcera, uma
cicatriz característica. Em geral a área
cicatricial está despigmentada, com uma leve depressão na pele, com uma fibrose
sob a epiderme.
FORMAS
CLÍNICAS
Um
amplo espectro de formas pode ser visto na leishmaniose tegumentar americana,
variando de uma lesão auto-resolutiva a lesões desfigurantes. Esta variação
está intimamente ligada ao estado imunológico do paciente e às espécies de Leishmania.
Asdformas
clínicas podem ser agrupadas em três tipos básicos: leishmaniose cutânea (LC),
leishmaniose cutaneomucosa (LCM) e leishmaniose cutânea difusa (LCD).
Leishmaniose
cutânea
A
leishmaniose cutânea é caracterizada pela formação de úlceras únicas ou
múltiplas confinadas na derme, com a epiderme ulcerada. A densidade de parasitos
nos bordos da úlcera formada é grande nas fases iniciais da infecção, com
tendência a escassez nas úlceras crônicas. Inicia como uma pequena inflamação,
podendo evoluir para uma úlcera rasa de bordo saliente, cuja evolução é lenta e
tende à cronicidade. A leishmaniose cutâneo-disseminada é uma variação da forma
cutânea e geralmente está relacionada com pacientes imunossuprimidos.
A L. braziliensis provoca no homem lesões
conhecidas por úlcera-de-Bauru, ferida brava, ferida seca e bouba. As lesões
primárias são usualmente únicas, ou em pequeno número, mas frequentemente de
grandes dimensões, com úlceras em forma de cratera. O curso da infecção é
geralmente irregular e crônico. Esta espécie é responsável pela forma cutânea
mais destrutiva dentre as demais conhecidas.
Leishmaniose
cutaneomucosa
O
curso da infecção nas fases iniciais ocorre como na forma cutânea. Um dos
aspectos mais típicos da doença causada pela L. braziliensis é a freqüência com que o parasito produz, meses ou
anos após a lesão inicial primária, lesões destrutivas secundárias envolvendo
mucosas e cartilagens. Trata-se de um processo lento, de curso crônico. As
regiões mais comumente afetadas pela disseminação metastásica são o nariz, a
faringe, a boca e a laringe. O primeiro sinal de comprometimento mucoso
manifesta-se por eritema e discreto infiltrado inflamatório no septo nasal,
resultando em coriza constante e posteriormente em um processo ulcerativo.
Atinge depois o vestíbulo, as asas do nariz, o assoalho da fossa nasal, o
palato mole e a úvula, daí descendo para a faringe, podendo comprometer a
laringe e a traqueia. A destruição do septo provoca mudança anatômica e aumento
do órgão, que se constitui no chamado nariz de anta. Em muitos casos ocorre
completa destruição de toda a estrutura cartilaginosa do nariz.
O
processo ulcerativo pode atingir os lábios e se propagar pela face. Estas
graves mutilações criam ao paciente dificuldades de respirar, falar e se
alimentar. São frequentes, nesta fase, complicações respiratórias por infecções
secundárias, podendo levar o paciente ao óbito.
Leishmaniose
cutânea difusa
Caracteriza-se
pela formação de lesões difusas não-ulceradas por toda a pele, contendo grande
número de amastígotas. É causada no Brasil pela L. amazonensis. Esta entidade mórbida envolve amplas áreas da pele,
particularmente extremidades e outras partes expostas. O curso inicial se
processa com a formação de uma única úlcera. A multiplicidade de lesões é
resultado de metástases do parasito de um sítio para outro através de vasos
linfáticos ou migração de macrófagos parasitados. A doença está estreitamente
associada a uma deficiência imunológica do paciente e caracteriza-se por curso
crônico e progressivo por toda a vida do paciente, não respondendo aos
tratamentos convencionais.
EPIDEMIOLOGIA
A
leishmaniose tegumentar americana é primariamente uma enzootia de animais
silvestres. A transmissão ao homem
ocorre quando este penetra em áreas onde a doença ocorre, passando a ter um
caráter zoonótico.
Um
grande número de espécies de mamíferos age como reservatório de Leishmania. No hospedeiro mamífero, considerado o
reservatório natural do parasito, raramente a Leishmania produz doença. A
infecção usualmente permanece benigna e inaparente. Em hospedeiros acidentais,
entretanto, incluindo o homem e alguns animais domésticos, a infecção produz
comumente lesões na pele.
No
Brasil, a leishmaniose tegumentar americana ocorre em todos os estados, com
maior incidência na Região Norte. Em algumas zonas, a população exposta ao
risco de infecção pode ser numerosa,
incluindo crianças, enquanto em outras localidades a enfermidade está restrita
a grupos ocupacionais, como os que trabalham em zonas florestais. Geralmente é
mais comum em zonas rurais do que urbanas.
Leishmania braziliensis
É
a espécie mais amplamente distribuída e ocorre nos Estados do Pará, Ceará, Amapá,
Paraíba, Bahia, Espírito Santo, Rio de Janeiro, São Paulo, Paraná, Minas
Gerais, Goiás e Mato Grosso. A disseminação da L. braziliensis nestas regiões tem como característica comum a
destruição das florestas primárias e, consequentemente, a invasão por parte dos
vetores do peridomicílio.
Várias
espécies de animais domésticos têm sido encontradas infectadas com frequência,
entre elas cavalos, burros e cães.
Existe
uma estreita correlação entre prevalência e distribuição da infecção humana e
canina.
|
Parasito
|
Reservatório
silvestre
|
Reservatório
Urbano
|
Vetor
|
|
L. braziliensis
|
Roedores,
raposas
|
Cães,
cavalos
|
Lu. Intermédia
|
PROFILAXIA
O
controle de leishmaniose tegumentar americana é dificil nas vastas áreas
florestais do Brasil e, no presente momento, é
insolúvel.
Em
algumas situações é possível evitar a picada dos flebotomíneos através de
proteção individual, com a utilização de repelentes e utilização de
mosquiteiros de malha fina.
Recomenda-se
a construção das casas a uma distância mínima de 500m da mata. Devido à baixa
capacidade de vôo dos flebotomíneos, raramente ultrapassam esta distância.
Além
disso, o controle dos reservatórios domésticos é de grande importância.
A
solução ideal para o controle da leishmaniose tegumentar, no Brasil, é a
produção de uma vacina. Os ensaios realizados mostraram que a vacina induz uma
sensibilização demonstrável até 14 anos após vacinação (resultados obtidos em
indivíduos vacinados e residentes em zona endêmica). A proteção conseguida foi
de 50% dos indivíduos vacinados e observados durante um ano. Atualmente estão sendo conduzidos
estudos no sentido de aumentar os níveis de proteção e de viabilizar sua utilização
em áreas de alto risco.
DIAGNÓSTICO
Diagnóstico
clínico
O
diagnóstico clínico da LTA pode ser feito com base na característica da lesão
que o paciente apresenta, associado a anamnese, na qual os dados
epidemiológicos são de grande importância. Deve ser feito o diagnóstico
diferencial de outras dermatoses granulomatosas que apresentam lesões semelhantes
à LTA e que podem ser confundidas.
Diagnóstico
laboratorial
A
demonstração do parasito pode ser feita do material obtido da lesão existente
através de:
-
Exame direto de
esfregaços corados. Após anestesia local, pode-se fazer biópsia ou curetagem
nos bordos da lesão.
-
Exame
histopatológico. O fragmento de pele obtido pela biópsia é submetido a técnicas
histológicas de rotina e exame por um experiente patologista. O encontro de
amastígotas ou de um infiltrado inflamatório compatível pode definir ou sugerir
o diagnóstico, respectivamente.
-
Cultura. Pode ser
feita a cultura de fragmentos do tecido ou de aspirados dos bordos da lesão e
de linfonodos infartados de áreas próximas a esta.
-
Inóculo em animais.
Inocula-se via intradérmica um triturado do fragmento com solução fisiológica.
Pesquisa
do DNA do parasito
A
PCR (reação em cadeia da polimerase) tem se mostrado como uma nova opção de
diagnóstico de LTA. As biópsias das bordas das lesões de pacientes suspeitos de
serem portadores de LTA são fontes de pesquisa de DNA de Leishmania sp., pela PCR.
Métodos
imunológicos
O teste imunológico mais
utilizado no Brasil tem sido o teste intradérmico de Montenegro. Este teste
avalia a reação de hipersensibilidade retardada do paciente e é utilizado para
o diagnóstico ou para monitorização de programas de vacinação contra LTA, ora
realizado no Brasil. O teste consiste no inóculo de 0,l ml de antígeno intradermicamente
na face interna do braço. No caso de reações positivas, verifica-se o estabelecimento
de uma reação inflamatória local formando um nódulo ou pápula que atinge o auge
em 48-72 horas, regredindo então.
Métodos para a avaliação da
resposta humoral
Reação de Imunofluorescência
Indireta (RIFI): sua sensibilidade é relativamente alta, variando nos estudos
realizados. Os títulos de anticorpos são normalmente baixos em casos com lesão
cutânea recente, mas podem estar aumentados nas formas crônicas da doença,
especialmente em casos de envolvimento mucoso.
Em algumas áreas onde há
dificuldade na realização da pesquisa do parasito, o diagnóstico pode ser feito
com base na avaliação clínico-epidemiológica associada ao teste de Montenegro.
Leishmaniose
Tegumentar do Velho Mundo
INTRODUÇÃO
A
leishmaniose tegumentar que ocorre no Velho Mundo é, sem dúvida, uma antiga
doença do homem. A doença ocorre em áreas onde há atividade humana,
refletindo-se em diferentes taxas de incidência. Alguns brasileiros que
trabalharam na construção de rodovias e áreas de irrigação no Oriente contraíram
infecção que foi diagnosticada no Brasil. Este fato pode levar, teoricamente, a
introdução de espécies alopátricas de Leishmania no Novo Mundo.
AGENTE ETIOLÓGICO
Três
espécies de Leishmania são conhecidas
como agentes etiológicos do botão-do-oriente:
-
L. (L.) tropica;
-
L. (L.) major;
-
L. (L.) aethiopica.
MORFOLOGIA
Similares
a Leishmania braziliensis, se
distinguem entre si e de outras espécies através do perfil eletroforético de
isoenzimas e de outras técnicas na área de biologia molecular.
DIAGNÓSTICO
Semelhante
ao utilizado na leishmaniose tegumentar americana.
EPIDEMIOLOGIA
Na
leishmaniose cutânea antroponótica ou urbana, causada pela L. tropica, o homem é considerado o único hospedeiro que mantém a
infecção na natureza.
Na
leishmaniose cutânea zoonótica ou rural causada pela L. major, a doença é mantida usualmente por reservatórios que são
roedores de hábitos diurnos.
A
leishmaniose cutânea por L. aethiopica
ocorre, principalmente, em áreas montanhosas da Etiópia e Monte Elgon, no
Quênia.
PROFILAXIA
O
controle tem como base medidas contra os vetores e reservatórios.
O
controle dos flebotomíneos é pouco prático na prevenção da leishmaniose cutânea
zoonótica. O controle de roedores e a modificação do meio ambiente são necessários
para a infecção zoonótica.
Uma
das formas tradicionais do controle da leishmaniose cutânea do Velho Mundo foi
a vacinação.
TRATAMENTO
Similar
ao da leishrnaniose tegumentar americana
Assinar:
Postagens (Atom)







