TUMORES
São tumores
invasivos preveníveis. Os programas de screening têm reduzido sua incidência. É
o 3º tipo mais comum de câncer diagnosticado em homens e o 2º em mulheres.
Também houve melhora significativa do tumor metastático de cólon nos últimos 10
anos. Aumenta significativamente com a idade, principalmente a partir de 50
anos (90% dos casos), sendo raro antes dos 40 anos de idade. A maioria ocorre
em homens. É responsável por 9% das mortes de câncer nos EUA, sendo que um a
cada 3 portadores morrerão devido a este. A maioria das vezes trata-se de um
adenocarcinoma, derivado do epitélio glandular colônico.
Fatores de
risco:
·
Baixo nível sócio-econômico ( devido a alimentação
mais gordurosa e menor screening);
·
Dieta rica em gordura;
·
Tabagismo;
·
Obesidade
·
Baixa taxa de screening;
·
Familiar (embora a maioria dos cânceres sejam
esporádicos). Câncer ou pólipos adenomatosos, vilosos ou tubulovilosos >1cm
em membros da família (maior risco para o câncer).
·
Polipose adenomatosa familiar (10% dos casos):
desenvolvimento de grande numero de pólipos no cólon (tem grande potencial de
malignidade, indica colectomia total);
Patologia:
Se originam de
um pólipo adenomatoso que sofre displasia e se transforma em câncer. Enquanto crescem penetram na submucosa,
invadem os linfáticos e ganha acesso as linfonodos e tecidos vizinhos. Porém,
tem velocidade de crescimento muito lenta, por isso, é previnível.
Principalmente pólipos >10mm tem maior possibilidade de dar origem ao
câncer. Já os hiperplásicos não progridem para o câncer. Eles podem ser de 2
tipos: lesões polipoides ou anulares constritivas. Apresentam algumas
características dependendo do cólon acometido:
·
Tumores de colón direito: são frequentemente
polipoide, as fezes são mais liquefeitas e raramente dão manifestações clinicas
precoces;
·
Tumores de colón esquerdo: são frequentemente
anulares, as fezes são mais endurecidas e dão manifestações mais precocemente
(causa sintomas de obstrução). Consiste na maioria dos tumores.
Microscopicamente
a maioria são adenocarcinomas, são similares e possuem o mesmo prognostico. A
formação glândula depende do grau de diferenciação.
Eles podem
disseminar-se através da parede do intestino, através de vasos linfáticos,
através da veia porta para o fígado e para toda a cavidade peritoneal Os
Principais sítios de metástases são os linfonodos regionais (complementar o
tratamento com quimioterapia), fígado e pulmões (menos frequentemente). O tumor
de reto inferior pode dar metástases pulmonares mais frequentemente devido a
sua drenagem direta para a VCI.
Manifestações clinicas
A maioria dos
tumores hoje é diagnosticada através de screening, e, portanto em pacientes
assintomáticos. Os sintomáticos podem se manifestar com sangramento anal
(oculto ou exteriorizado), anemia, perda de peso, mudança de habito intestinal
(constipação e diarreia), dor abdominal em hipogástrio (câncer avançado, já com
obstrução), obstrução intestinal e presença de massa abdominal palpável.
Em tumor de
colón ascendente pode haver sangramento ou diarreia (tem grande calibre e por
isso obstruções são raras, são tumores maiores e mais invasivos ao diagnostico).
O tumor de colón descendente e sigmóide se manifesta com obstrução intestinal,
dor abdominal, mudança de habito intestinal (isso porque ele possui menor
calibre e contém fezes semi-sólidas). No câncer retal predomina a hematoquezia
de pequena monta, persistente ou intermitente.
OBS: Doença diverticular dos colóns
transversos e descendente pode gerar sangramentos muito mais que os cânceres de
colón, no sigmoide esses divertículos não sangram inflamam principalmente em
idosos gerando um quadro de diverticulose, e o diagnostico é feito com TC.
Pode haver
ainda fistulas enterro-vesicais (pneumaturia, infecção urinaria de repetição),
endocardite infecciosa por Streptococos bovis (habitante natural do colón que
tem avidez por válvulas cardíacas, toda vez que ele é isolado deve fazer
colonoscopia, porque o colón é a porta de entrada para esse agente). Pode haver
ainda manifestações relacionadas a metástases que estão presentes em 20% dos
pacientes ao diagnostico (hepatomegalia dolorosa, ascite, disfunção de bexiga,
corrimento e sangramento vaginal e o comprometimento pulmonar e ósseo).
Diagnostico
A
anamnese cuidadosa (pesquisa de casos na família) é fundamental. Deve-se
suspeitar de câncer coloretal em todo paciente, principalmente idoso que
apresente sangramento retal, dor abdominal, modificação de hábitos intestinais,
emagrecimento e anemia. Caso se faça diagnostico de um tumor de reto ou
sigmoide pela retossigmoidoscopia, é necessário à complementação com
colonoscopia, pois muitos pacientes podem apresentar tumor sincrônico (tumor
primário em locais diferentes do colón). Apenas 66% dos canceres colorretais
são detectados pela retossigmoidoscopia.
PSOF (pesquisa de sangue oculto
nas fezes)
É um exame importante para triagem do câncer
coloretal. A triagem desse câncer se inicia após 50 anos de idade e após os 40
anos para pacientes com historia familiar de câncer coloretal. São usados 4 estratégias de rastreamento:
pesquisa de sangue oculto nas fezes, uma vez ao ano; sigmoideoscópia flexível a
cada 5 anos, colonoscopia a cada 10 anos.
A pesquisa de sangue oculto nas fezes se
baseia no fato que a maioria dos adenocarcinomas ocasionarem sangramento. Esse exame detecta anticorpos contra hemácia
humana, porém devido ao fato do sangramento poder ser intermitente, pode haver
resultados falsos-negativos. Para diminuir isso o exame é feito com três
amostras consecutivas de fezes.
Estudo onde
que pegou 33.000 pacientes seguidos por quase 30 anos e avaliou a validade da
pesquisa de sangue oculto nas fezes (o normal é esse exame vir negativo. Sua
positividade significa que o paciente esta perdendo sangue de algum local).
Dividiram então os pacientes em 3 grupos, um grupo sem acompanhamento da
pesquisa de sangue oculto, outro a cada 3 anos e outro a cada ano. O estudo
mostrou que esse exame reduziu significativamente a incidência de morte
relacionada ao câncer, porém não reduziu a mortalidade total. Outro estudo
mostrou que a colonoscopia detecta mais precocemente o câncer coloretal que o
sangue oculto. Assim, se esse exame vem
positivo deve fazer colonoscopia e se vier negativo pode repetir.
Enema
opaco:
Outro exame
utilizado é o enema opaco, permite detectar lesões, com irregularidade na
mucosa. Lesão característica “maça mordida”.
CEA
Antígeno
carcinoembrionário. Não tem nenhum valor para screening, porém tem valor
prognostico (níveis elevados em caso de doença avançada) e prè e pós-operatório
(é bom para segmento do paciente). Níveis elevados indicam doença avançada.
Colonoscopia
virtual
Colonoscopia
feita pela tomografia computadorizada (abdominal que visualiza apenas a luz
intestinal). Problemas: radiação e não permite retirada de lesão.
Dos exames o
que tem melhor sensibilidade é a colonoscopia.
Colonoscopia
Melhor exame
para screening e diagnostico (permite detectar câncer e presença de pólipos). Permite
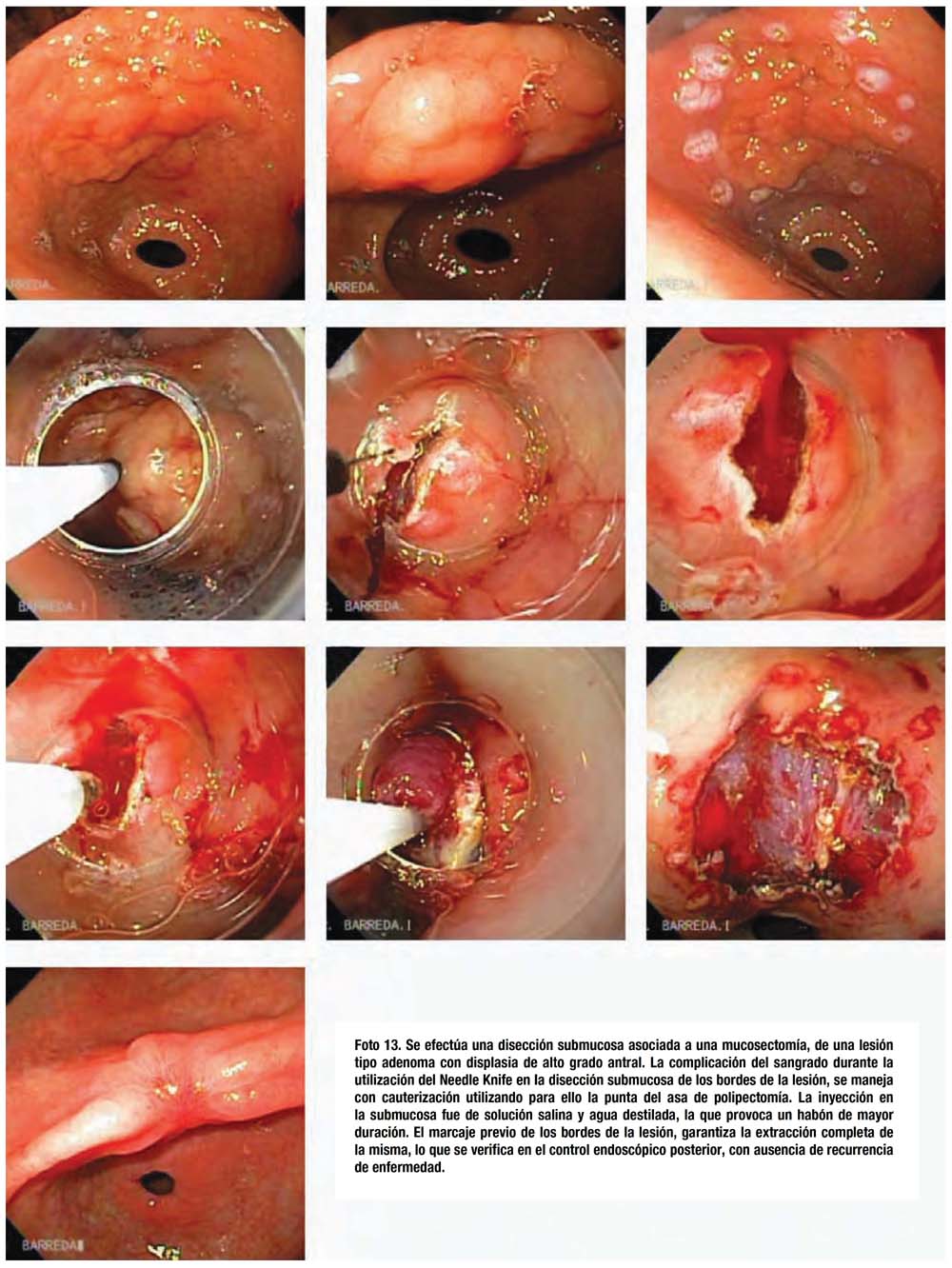
visualização direta da lesão e exérese de pólipos, biopsia de lesões. Previne
câncer colorretal e mortes. As complicações desse exame ocorrem em 1/1000 procedimentos
e são as seguintes: hemorragias ou perfurações. Até 20% dos pólipos podem ser
vistos em uma colonoscopia. OBS: A esqusistossomose pode gerar uma lesão
psudotumoral (lesão com áreas de necrose). Quando fazer e
repetir a colonoscopia?
A 1ª colonoscopia
dever ser feita com 50 anos. Se normal repete ela após 10 anos, sem necessidade
de fazer pesquisa de sangue oculto. Se 1 ou 2 polipos adenomatosos < 5 mm
recomenda-se repetir com intervalo de 5 anos. Se polipo adenomatoso >10mm ou
displasia de alto grau deve-se repetir em 3 anos.
Fatores de mau prognostico além da TNM:
O esquema de
estadiamento proposto é o TNM. Quanto maior o estagio do tumor pior o
prognostico.
Os fatores de maus prognostico
são:
·
Pacientes sintomáticos ao diagnostico;
·
Quanto mais distal no colón, pior prognostico;
·
Envolvimento da serosa subjacente;
·
Envolvimento linfonodos regionais : já define
necessidade de quimioterapia adjuvante á
cirurgia. Quanto maior o número de linfonodos acometidos pior é o diagnostico.
·
Envolvimento de meso;
·
Invasão vascular;
·
Tumor residual;
·
CEA elevado antes da cirurgia e não abaixamento
após a ressecção;
·
Grau de diferenciação tumoral.
Tratamento:
Cirurgia é curativa
apenas para as formas localizadas (estádio I-II). Opção curativa limitada para
pacientes em estádio IV com metástases hepáticas e/ou pulmonares. Para lesões
de ceco e colón direito faz-se hemicolectomia direita. Lesões de flexura
esplênica e colón descendente faz-se hemicolectomia esquerda. Lesões de
sigmoide faz-se a sigmoidectomia (preserva o reto e o colón transverso). Se
houver presença de linfonodos acometidos e/ou metástases deve-se associar a
quimioterapia á cirurgia. A abordagem cirúrgica é através da ressecção do
segmento acometido, com amplas margens de segurança, somada a ressecção dos
linfonodos regionais, meso e suprimento vascular.
Ressecções de metástases hepáticas permitem melhora na sobrevida e tem
melhores resultados em pacientes com metástases únicas, menores que 5 cm e com
CEA menor que 200ng/ml.